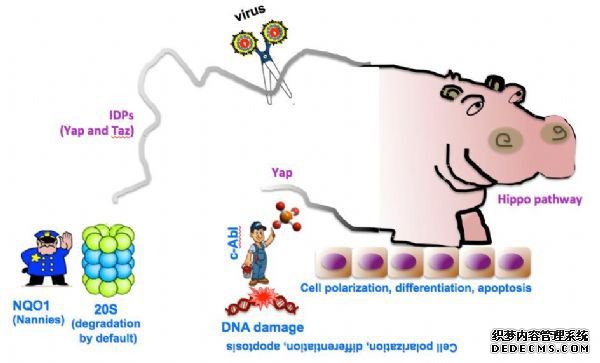
之前他们就已经发现,通过磷酸化位于Y433的MST1,蛋白激酶c-Abl介导了氧化应激诱导的神经元细胞的死亡。
Hippo信号通路在生物个体发育特别是组织器官大小调控过程中具有关键功能,同时在肿瘤发生及免疫应答过程中发挥十分重要的作用。周兆才研究组长期致力于肿瘤发生及免疫应答的分子细胞信号机制研究,近期一系列工作揭示了Hippo、TLR等信号通路在胃肠道恶性肿瘤及免疫应答中的机制与功能,发现了多个新的疾病诊疗标识物及药物靶标。
陈策实研究员领导的课题组的研究表明,促进细胞增殖和生存的干细胞转录因子KLF5是TAZ的重要合作伙伴,TAZ的WW结构域与转录因子KLF5的PY序列相结合,拮抗WWP1 介导的KLF5的蛋白降解,从而保护KLF5免受WWP1介导的泛素化降解,促进KLF5的下游基因表达、细胞增殖以及肿瘤生长。这个工作今年早期已经发表在《Carcinogenesis》。但是YAP是否通过类似的机制行使功能还不清楚。
国际知名学术期刊《PLoS Biology》在线发表了中科院上海生科院生化与细胞所张雷研究组、刘新垣研究组和赵允研究组合作完成的最新研究成果——“Par-1 regulates tissue growth by influencing hippo phosphorylate on status and hippo-salvador association”。在这项工作中,博士研究生黄宏龄等人发现了一个新的Hippo信号通路成员Par-1激酶,阐明了其在Hippo信号通路中负调控Hippo激酶活性的作用机制,并初步揭示了这种调控机制的保守性。
研究发现,MSTs通过剪切,自身磷酸化,并磷酸化下游靶点(如组蛋白H2B及FOXO),促进了凋亡的发生。
2017年12月1日,Cell最新一期杂志发表了来自加州大学圣地亚哥分校管坤良教授课题组的一篇题为“The Hippo Pathway Kinases LATS1/2 Suppress Cancer Immunity”的重要文章,这项研究也是近两年来Hippo信号通路领域最重大的发现之一。在这项研究之前,研究人员似乎对Hippo信号通路参与调控肿瘤免疫原性并不清楚,在敲除LATS1/2的条件下,小鼠体内能够诱导增强抗肿瘤免疫从而抑制肿瘤的发生,而此前很长一段时间内大多数研究表明Hippo信号通路的失活能诱导部分器官的肿瘤发生,并且此前LATS1/2也被公认为是抑癌基因,而在坤良老师这篇Cell中LATS1/2又表现出具有抑制免疫原性的“癌基因”特性。
Hippo通路是一条由一系列蛋白激酶和转录因子组成的激酶链;从低等动物到高等动物, Hippo信号通路都具有高度保守性,该信号通路在机体细胞的各个方面都扮演着重要的角色,超变态网页游戏大全,本文中,小编整理了和Hippo信号通路相关的亮点研究,分享给大家!
【2】Nature:治疗心脏病有戏!阻断Hippo通路可逆转重度心力衰竭
在一项新的研究中,来自美国贝勒医学院、德克萨斯心脏研究所和中国上海儿童医学中心的研究人员发现了心脏的一种之前未被识别的愈合能力。在小鼠模型中,他们能够通过沉默Hippo活性来逆转重度心力衰竭。Hippo信号通路能够阻止心肌再生。相关研究结果于2017年10月4日在线发表在Nature期刊上,论文标题为“Hippo pathway deficiency reverses systolic heart failure after infarction”。
doi:10.1038/ncb2615
doi:10.1371/journal.pone.0036562
doi:10.1038/onc.2013.88
Hippo信号转导通路是几年前发现的一个信号转导通路。研究发现Hippo信号通路是参与调控器官大小发育的关键信号通路,这一观点首先在果蝇中被发现,后来的研究发现在哺乳动物的发育过程中Hippo有相同的功能。近年来越来越多的证据表明,这条信号通路还调控干细胞自我更新及组织再生,特别是与癌症的发生密切相关。因而这一通路的研究不但是发育生物学的重要课题,而且对人类疾病的治疗具有指导意义。
【1】Nature:研究发现阻断Hippo通路可逆转重度心力衰竭
doi:10.1371/journal.pbio.1001620
doi:10.1038/onc.2017.24
论文通信作者、贝勒医学院再生医学教授、德克萨斯心脏研究所心肌细胞更新实验室主任James Martin博士说,“心力衰竭仍然是心脏病死亡的主要原因。目前这种疾病的最好治疗方法是植入一种心室辅助装置或进行心脏移植,但是可供移植的心脏数量是有限的。”
中科院科学家焦仁杰等人最近在著名期刊Cell Research期刊在线发表了题为“SCFSlmb E3 ligase-mediated degradation of Expanded is inhibited by the Hippo pathway in Drosophila”的研究成果,报告了Hippo信号通路调节果蝇发育过程中细胞增殖稳态新机制。
哺乳动物Ste20样激酶(MSTs)是果蝇hippo的同源物,在调节细胞死亡,控制器官大小,细胞增殖及肿瘤发生过程中有着至关重要的作用。
【6】PLoS Biol:张雷等发现Hippo信号通路新成员Par-1通过调节Hippo激酶调控组织生长

doi:10.1038/cr.2014.166
doi:10.1038/nature24045
文章的通讯作者是早年毕业于杭州大学的管坤良教授,管教授主要从事细胞生长调控、肿瘤生物学以及神经生物学的信号转导途径等方面的研究,他曾荣获过包括美国“麦克阿瑟天才奖”在内的多项荣誉,现任加州大学圣地亚哥分校教授,浙江大学生命科学研究院兼职教授、共同院长等职务。
【7】Onco Cancer Res:袁增强等Hippo信号通路和癌症及细胞衰老研究获进展
近日,中国科学院生物物理研究所的袁增强课题组发现,c-Abl-Hippo/MST2信号通路调节了神经元细胞的死亡。相关论文发表在5月9日的PLoS ONE。
doi:10.1016/j.cell.2016.11.005
免疫原性差的肿瘤细胞在宿主免疫防疫的过程中会发生逃逸,当在肿瘤中敲除LATS1/2时,能够刺激核酸富集的胞外囊泡的分泌,然后诱导Toll样受体MYD88/TRIF介导的I型干扰素应答。I型干扰素应答能够刺激宿主免疫反应中的多种成分最终激活T细胞,活化后的T细胞有能够协助肿瘤特异性的细胞毒性T细胞应答和B细胞的抗体产生,最终破坏肿瘤形成(详见下图的作用模型)。
4月5日,国际学术期刊Oncogene在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所/分子细胞科学卓越创新中心周兆才研究组的最新研究成果DNA-binding mechanism of the Hippo pathway transcription factor TEAD4。该研究在原子水平上阐明了Hippo信号通路下游关键转录因子TEAD4特异性识别结合DNA的机制。助理研究员史竹兵和硕士研究生何峰是该论文共同第一作者。
【5】Cell Research:Hippo信号通路调节果蝇发育过程中细胞增殖稳态新机制
来自加州大学圣地亚哥分校、哈佛大学的研究人员发表了题为“YAP mediates crosstalk between the Hippo and PI(3)K–TOR pathways by suppressing PTEN via miR-29”的文章,证实YAP通过miR-29抑制PTEN介导了Hippo与PI(3)K–TOR信号通路之间的串扰。相关成果发布在11月11日的《自然细胞生物学》(Nature Cell Biology)杂志上。
2013年4月1日在Oncogene上在线发表的文章报道了YAP2新的分子调控机制在肝癌细胞增殖及耐药性中的作用。YAP2作为原癌蛋白存在多种翻译后修饰(磷酸化和泛素化等),调控其转录活性与功能。研究揭示了YAP2新的翻译后修饰——乙酰化和去乙酰化,鉴定SIRT1作为YAP2的主要去乙酰化酶,增强YAP2与转录因子TEAD4的结合,促进其转录活性,并且在抗肿瘤药物(CDDP)处理下使YAP2入核发挥转录因子的功能,从而增强肝癌细胞的增殖及对抗肿瘤药物的抵抗。与之对应的是,肝癌标本中SIRT1的蛋白水平明显高于正常组织,而且与YAP2的下游靶基因CTGF表达呈明显正相关。这些结果为揭示肝癌的发生发展机制及肝癌的治疗提供了新的依据。
【3】Oncogene:研究阐明Hippo通路关键转录因子TEAD4特异性结合DNA机制
心脏病发作时,血液停止流进心脏中,由于缺氧,部分心肌会死亡。心肌不会再生;相反,死亡的心脏组织被由成纤维细胞组成的瘢痕组织替换,这种替换并不有利于心脏泵血。心脏在功能上减弱;大多遭受严重心脏病发作的病人会患上心力衰竭。
【9】AJP:陈策实等乳腺癌Hippo信号通路研究获进展
【8】NCB:揭示Hippo信号新机制